중요성
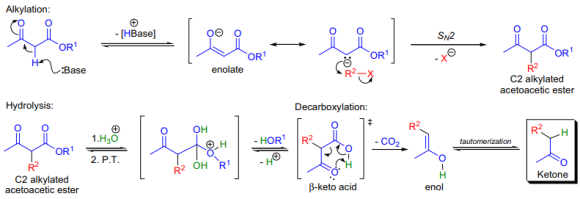
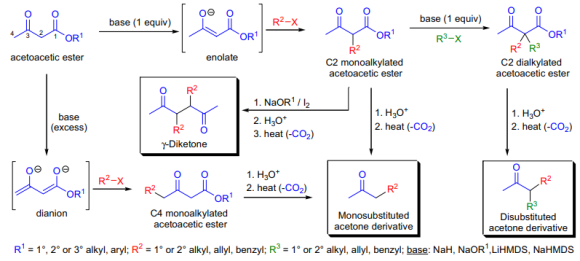
3-oxobutanoicacid의 ester(acetoaceticester)의 C-alkylation에 의한 ketone 준비를 acetoacetice stersynthesis라고 한다. acetoaceticester는 사용하는 염기의 양에 따라 C2 또는 C2와 C4 탄소 모두가 de protonated 될 수 있다. C2 탄소 원자의 C-H 결합은 인접한 두 carbonyl기의 electron with drawing effect에 의해 활성화된다. 이들 프로톤은 상당히 산성(C2의 경우 pKa~11, C4의 경우 pKa~24)이기 때문에 염기(sodiumalkoxide, LDA, NaHMDS, LiHMDS 등)를 당량 사용하면 우선 C2 위치가 de 프로톤ated 된다.생성되는 음이온은 다양한 alkylatingagent에 trapped 될 수 있다. 다른 염기와 alkylatingagent를 1kg 더 사용하면 C2에 두 번째 alkylation이 가능하다. acetoaceticester에 과량의 염기를 가하면 dianion(extendedenolate)이 만들어진다.(alkylhalide와 같은) electrophile을 dianion에 가하면 먼저 가장 nucleophilic한(반응성이 좋은) C4 위치에 alkylation이 일어난다. 그 결과 만들어지는 alkylated acetoaceticester 유도체는 조건에 따라 두 종류의 가수 분해를 진행할 수 있다.
얇은 산으로 ester기를 가수분해하고 이를 통해 생성되는 β-ketoacid는 decarboxylation을 진행하여 ketone(mono-또는 disubstituted acetone 유도체)을 만들어낸다.염기수용액은 retro-Claisen reaction을 일으키며 프로톤ation 후 acid를 만들어낸다.
약산을 이용한 가수분해가 가장 많이 사용된다. 반응 혼합물이 ketonic scission에서 유도되는 부산물에 의해 오염되지 않기 때문이다. 좀 더 최근에는 크래프차박스를 이용하면 중성 조건으로 디카박시일이 가능하다. malonicester와 같이 acetoaceticester의 monoalkyl 유도체는 iodine 존재 하에서 base-catalyzed coupling reaction을 진행한다. 커플링된 product를 가수분해와 decarboxylation 시키면 –diketone이 만들어진다. 처음 출발하는 acetoaceticester는 통상 대응하는 ester의 Claisencondensation을 통해 만들지만 다른 방법도 가능하다.
메커니즘
첫 단계는 당량의 염기로 C2 위치에서 acetoaceticester를 deprotonation시키는 것이다. 그 결과 생성되는 enolate는 nucleophilic이기 때문에 electrophilic한 alkylhalide와 SN2 반응을 통해 C2 위치가 치환된 acetoaceticester가 만들어지며 이는 분리가 가능하다. ester는 산수용액으로 처리하여 가수분해시키면 베타카타시드가 만들어지는데, 이는 열적으로 불안정하여 육각형 전이 상태를 거쳐 디카박시일레이션을 진행한다.
합성 응용
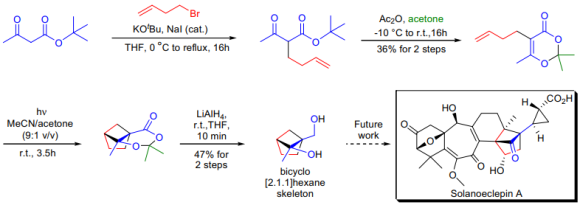
H. Hiemstra 연구실에서 분자내광화학 dioxenone-alkene[2+2] cycloaddition 반응을 통해 solanoeclepinA의 bicyclo[2.1] hexane 부분구조 합성을 진행하였다. dioxenone 전구체는 acetoacetice stersynthesis를 이용하여 상업적으로 가능한 tert-butylacetoacetate에서 준비하였다. 이 dioxenone 전구체에 300nm 빛을 조사하면 약 4시간 후 출발물질이 모두 전환된 것을 확인하고 예상한 cycloadduct이 준수한 수준의 수율로 형성됐다.
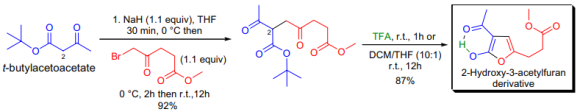
R. Neieretal.은 α-haloketone에서 tert-butylacetoacetate를 alkylation시킨 후 중간체를 trifluoroaceticacid로 처리하여 치환된 2-hydroxy-3-acetylfuran을 합성하였다. furan을 β-ketoester와 α-haloketone으로 준비할 경우 이러한 반응은 Feist-Bénary reaction으로 알려져 있다. 다양한 bromoalkane에서 C2alklated 중간체에 두 번째 alkylation을 하고 2, 2-disubstited product을 만들어 TFA에서 처리한 후 trisubstited furan으로 진행할 수 있었다.
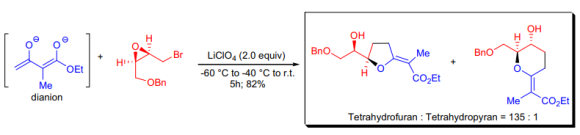
M. Nakada와 동료 연구자들은 acetoaceticester의 dianion과 epibromohydrin 유도체를 반응시켜 tetrahydrofuran과 tetrahydrofuran 유도체의 새로운 합성법을 개발했다. tetrahydrofuran 유도체의 선택적 형성은 LiClO4를 첨가제로 사용 가능하게 하였다.
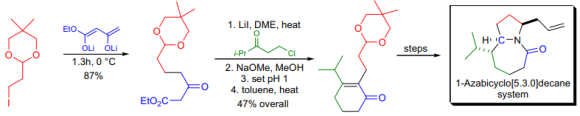
C.H.H.Heathck 연구실에서 Stemonaalkaloid의 전형적인 핵심 구조에 대한 합성 전략을 개발하였으며 1-azabicyclo[5.3.0] decaneringsystem 전구체는 ethylacetate의 dianion을 연속적으로 두 번 alkylation시켜 준비하였다.